Où et comment les trouver ?
- Méthodes d’inventaire et milieux prospectés
- La technique de la chambre humide.
Méthodes d’inventaire :
Durant les stades mobiles de leur vie, les myxomycètes sont essentiellement des prédateurs de bactéries, qu’ils vont phagocyter dans des milieux très divers, mais toujours suffisamment humides pour permettre leurs déplacements. Ils ne s’en écarteront guère au moment de l’élaboration de leurs fructifications, cherchant simplement à s’élever sur les supports à leur portée afin d’assurer maturation et séchage des sporocarpes, et dispersion optimale de leurs spores.
Nous avons donc exploré les supports potentiels dans les milieux susceptibles d’accueillir les myxomycètes. Comme ils se développent souvent en grand nombre, ils attirent facilement le regard. Une loupe de grossissement 10X permet de confirmer leur présence et d’apporter des premiers éléments de détermination. Après prélèvement cette dernière se poursuit en laboratoire, où les récoltes sont examinées à l’aide d’une loupe binoculaire Nikon grossissement 9 à 80 fois et d’un microscope Realux BK 5000 muni des grossissements 40, 100, 200, 400 et 1000 avec huile à immersion. Les montages pour l’observation microscopique sont généralement faits à l’eau pure, quelques préparations ont été faites dans le conservateur de Hoyer ou avec un colorant.
Les milieux forestiers ont été les plus prolifiques, le bois mort en étant l’élément essentiel et indispensable. Les branches et les troncs au sol accueillent 70% des espèces que nous avons recensées. Les sporocarpes se situent la plupart du temps à la face infère, parfois aussi à l’intérieur du bois mort, la moindre fissure étant un espace suffisamment grand pour les accueillir. Plus rarement de manière très apparente et spectaculaire à la surface des troncs, comme sur ces charmes en forêt de Haguenau.
Certaines espèces sont très ubiquistes, d’autres plus ou moins spécialisées. Physarum album a été rencontré sur tout type de bois, avec l’écorce ou décortiqué, feuillu ou résineux, fraichement à terre ou au contraire dans un état de décomposition avancé, sur des ramilles ou des troncs de gros diamètre, parfois sur la litière de feuilles mortes. Par contre nos observations de Badhamia utricularis se sont faites essentiellement sur bois de feuillus, comme les charmes ci-dessus, et aussi souvent sur chênes fraichement abattus.
Les aulnaies nous ont également apporté un bon nombre d’espèces, dont certaines spécialisées, comme Comatricha rutilipedata sur strobiles d’Aulne glutineux (Alnus glutinosa).
La végétation vivante est parfois également colonisée, sans dommage pour elle puisqu’elle ne joue qu’un rôle de support. Ici également on retrouve des espèces ubiquistes et d’autres plus spécialisées. Ainsi Didymium melanospermum se rencontre souvent sur les touffes de Polytrichum formosum qui lui permettent d’élever ses sporocarpes au dessus de la strate muscinale, mais également sur d’autres bryophytes et sur le bois mort. Par contre Diderma ochraceum n’a été observé que sur l’hépatique Bazzania trilobata, sur les rochers des talus ou dans les barres rocheuses.
Les écorces d’arbres vivants sont aussi un milieu favorable, leurs anfractuosités pouvant abriter de minuscules espèces. Certaines sont ubiquistes, d’autres préfèrent les feuillus ou les résineux, l’une a même élu comme unique domicile les blessures des épicéas, là où coule la résine, au milieu d’un champignon anamorphe dont nous ignorons le nom.
Sorti des milieux strictement forestiers nous avons prêté une attention particulière à des micro habitats :
des lianes : des Clematites (Clematis vitalba, C. viticella), de la vigne (Vitis vinifera), de la vigne vierge (Parthenocissus sp.), du lierre (Hedera helix) et du houblon (Humulus lupulus). Nous y avons recensé 5% des espèces présentes sur le territoire du PNRVN, dont Licea eleanorae, espèce n’ayant été observée sur aucun autre milieu. Le jardin botanique de Strasbourg possède une collection de Clématites sur laquelle nous avons effectué la première récolte française de Protophysarum phloiogenum.

Clematis tibetana subsp. vernayi jardin botanique de Strasbourg
- des écorces d’arbres vivants de milieux divers tels que jardins, vergers, haies et parcs en milieu urbain : 10% des espèces du PNRVN, dont 5 n’ayant été observées dans aucun autre milieu.
- des végétaux semi ligneux vivants ou secs sur pied : des lavandes (Lavandula angustifolia, L. stocheas, L. dentata) et des giroflées (Erysimum sp.) sur lesquelles sont présentes 5% des espèces du PNRVN, sept d’entre elles n’ayant été trouvées sur aucun autre milieu).
- des débris végétaux divers sur les composts : nous n’y avons trouvé que des espèces fréquentes, à l’exception de Fuligo cinerea venu uniquement sur ce type de substrat.
- des fèces d’herbivores : cheval, chevreuil, lièvre. Une espèce rare (Hemitrichia pardina) a été trouvée sur crottin de cheval en 2010, 2011 et 2012.
- enfin une mention spécifique doit être faite pour une herbacée vivace de la famille des Asteracées, le Grand pétasite (Petasites hybridus), sous les feuilles duquel se développent 3 espèces de myxomycètes dont c’est l’habitat semble-t-il exclusif . Deux d’entre elles, Didymium tussilaginis et D. vernum, sont présentées ici. Malgré des recherches annuelles au printemps, nous n’avons pas encore observée la troisième, Diacheopsis sp., décrite par Andreas Kuhnt mais pas encore nommée (KUHNT A. & al., 2014).
10% des espèces du PNRVN se retrouvent dans ces 3 derniers milieux : composts, fèces et Pétasites.
Le tableau à télécherger ici récapitule espèce par espèce un exemple de récolte dans les Vosges du Nord, avec son substrat et son habitat.
Un milieu particulier, ou plus exactement une ambiance particulière, accueille des espèces qui se nourrissent des bactéries vivant dans le film d’eau existant entre le sol et une couche de neige d’épaisseur suffisante. On parle alors d’espèces nivicoles, ou nivales. Nous développons ce sujet ici.
La technique de la chambre humide
Les prospections de terrain telles que relatées ci-dessus ne sont pas suffisantes pour mener un inventaire aussi complet que possible. De nombreuses espèces sont trop petites pour être décelées de cette manière, aussi avons nous eu recours à la technique dite de la chambre humide. Cette méthode a été développée par Gilbert et Martin (1933) et elle est employée systématiquement lors des inventaires. Le principe consiste à prélever des substrats potentiellement porteurs de spores ou de sclérotes, et à les placer dans un milieu confiné avec un taux d’humidité que l’on maintiendra élevé, des boites de Pétri par exemple. Nous avons adapté cette méthode et choisi des boites plastiques d’environ 15 x 10 x 4 cm, ce qui permet d’y placer des échantillons de taille supérieure et de créer ainsi une ambiance se rapprochant plus près des conditions naturelles que celle d’une boite de Pétri. Le couvercle est simplement posé sans être fermé hermétiquement, afin de laisser quelques échanges gazeux avec l’air ambiant. Nous garnissons le fond d’un papier absorbant et humidifions régulièrement à l’aide d’un vaporisateur. L’eau utilisée est simplement l’eau du robinet (sources d’Oberbronn) à température ambiante. Le milieu est observé à la loupe binoculaire tous les 4 à 5 jours.
Parfois des plasmodes ou des myxomycètes apparaissent au bout de quelques jours (un record de rapidité 3 jours est détenu par un Protophysarum phloiogenum sur Clematis flammula), mais plus généralement seulement après 4 à 5 semaines.
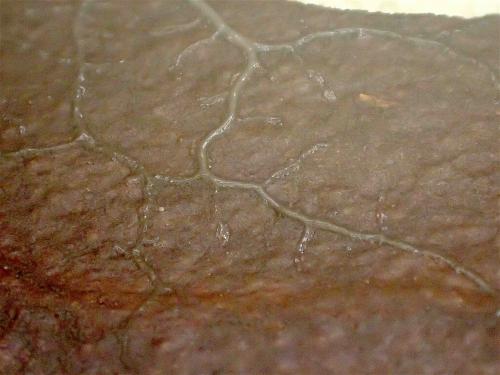
Parfois également des plasmodes ne se décident pas à fructifier. Ils peuvent décéder et laisser la boite vide de toute trace, ou bien rester à l’état de plasmode pour une durée indéterminée. Un exemple ci-dessous : des écorces de Pin sylvestre vivant ont été prélevées en forêt de Hanau le 15 septembre 2017 et mises en chambre humide le même jour. Le plasmode est apparu le 5 décembre 2017. Minuscule et translucide au début, il a grandi et s’est progressivement opacifié ; il a exploré tous les recoins de sa cellule, passant sous les écorces, revenant en surface, repassant et croisant ses traces, sans se lasser et sans daigner fructifier non plus. Jusqu’au jour du 21 mai 2019 où il est décédé sans signe annonciateur quelconque, ne laissant que quelques amas brunâtres au fond de la boite.
 17 mars 2019 |
|
 17 mars 2019 |
 17 mars 2019 |
Les substrats mis en chambre humide ont été les suivants :
- des écorces d’arbres vivants ; exemple dans le PNRVN : uniquement 6 écorces sur 4 sites ont apporté 3 espèces non obtenues par ailleurs, cela laisse suggérer un potentiel important et le procédé devra être renouvelé à plus large échelle
- des lianes comme citées ci-dessus
- des lavandes et des giroflées
- des fèces d’herbivores
Toujours dans le PNRVN : 22 espèces ont ainsi été obtenues uniquement en chambre humide, soit 18% de son inventaire.
De même que nos prospections de terrain, nos essais de mise en culture de divers substrats se poursuivent, apportant régulièrement l’une ou l’autre espèce que nous n’avions pas encore rencontrée.








